? 7 min
Tehnologija CRISPR-Cas9 – treba li ju posebno predstavljati? Upravo je taj sustav za precizno uređivanje genoma omogućio revoluciju genetičkog inženjerstva. Ipak, danas u fokusu neće biti sama primjena CRIPSR-Cas9 sustava u biotehnologiji, koliko god ona bila fascinantna (bez brige, na to ćemo se vratiti neki sljedeći put).
Danas je vrijeme da zavirimo u pozadinu onoga što stoji iza tog gotovo savršenog molekularnog alata koji se u današnjoj varijanti sveo na jedan enzim i jednu pažljivo odabranu molekulu RNA.
Mali povijesni pregled događaja koji su doveli do otkrića CRISPR/Cas9 sustava pomoći će nam da bolje razumijemo što taj sustav uopće jest, a i da osjetimo kako funkcionira današnja znanost – da su međusobna suradnja i dijeljenje znanja temelj na kojem počivaju sva velika otkrića.
Neki zbilja vole slano
Prva osoba koju ćemo upoznati je Francisco Mojica. Mjesto radnje je španjolsko Sveučilište u Alicanteu, a vrijeme radnje je 1989. godina, kada Mojica započinje svoj doktorat. Tamo je istraživao vrstu arheja Haloferax mediterranei, koje su posebno interesantne zbog toga što mogu najnormalnije živjeti u okolišu s ogromnom količinom soli koja bi ubila bilo koji običan mikroorganizam.
Njegov mentor nešto je ranije otkrio da slanost medija u kojem te arheje rastu ima utjecaj na cijepanje genoma posebnom vrstom enzima koje se nazivaju restrikcijskim enzimima. Ti enzimi su bakterijskog podrijetla, ali se često koriste u laboratorijima in vitro. Služe nam kako bi veliki genom nekog umjetno izrezali na fragmente koji se mogu dalje istraživati.
Ono što je Mojica zatim otkrio bilo je još veća zagonetka – u dobivenim fragmentima DNA pronašao je velik broj gotovo savršeno palindromskih sekvenci dugačkih 30 nukleotida. Mali podsjetnik: nukleotidi su gradivne jedinice svake molekule DNA, imamo 4 različite vrste koje se označavaju slovima A, T, G i C. U čitavom genomu ove arheje ih ima 294888, tako da je 30 zaista mali broj.
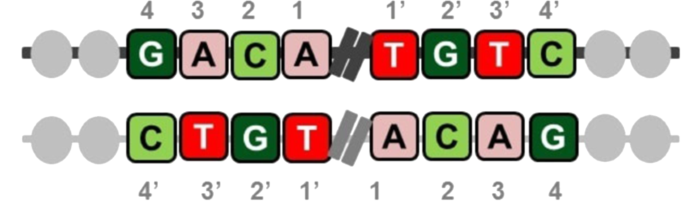
Za razumijevanje toga što je palindromska sekvenca, moramo se prisjetiti da DNA ima dva lanca – vodeći lanac i onaj koji je njemu komplementaran. Ako gledamo sekvencu DNA na vodećem lancu, njemu palindromska sekvenca je zapravo zrcalno preslikavanje komplementarne sekvence – dakle od posljednjeg pa do prvog slova. To je prikazano i na donjoj slici. Također, te su palindromske sekvence odvojene nekim potpuno drugačijim sekvencama (prikladnog naziva spaceri) od otprilike 36 baza.
Ali priča se zatim počinje komplicirati. Mojica je ubrzo je otkrio da njegove arheje nisu toliko posebne: slične strukture postoje u velikom broju drugih bakterija i arheja. Posebno je zanimljivo to da one nisu bile nimalo srodne, što je ukazivalo da je riječ o nečemu što ima bitnu funkciju, upravo zato jer se očuvalo kroz dugo razdoblje evolucije arheja i bakterija.
Francisco Mojica je tim genomskim motivima dao ime SRSR (Short Regularly Spaced Repeats), koje je 2002. godine promijenjeno u Clustered Regularly Interspaced Palindromic Repeats (CRISPR). U to vrijeme, znanstvenici su uspješno otkrili i neke gene koji redovno dolaze u paketu s tom CRISPR regijom genoma, tako da su nazvani CRISPR-associated ili cas genima.
Dobro je, sada nam je jasno što znači CRISPR, ali još nemamo odgovor na pitanje – čemu ti neobični dijelovi genoma služe?
Strpljen, spašen
Ponovno se nalazimo u Alicanteu, a godina je 2003. U ovoj fazi otkrića iznimno su važni bioinformatički alati i dostupnost javnih baza podataka koje sadrže sekvence dijelova genoma različitih organizama.
Zanimljive palindromimske sekvence u CRISPR regiji svakako upadaju u oko, ali Mojica se odlučio pozabaviti onim spacer senkvencama između njih. Tako je Mojica za apsolutno svaki spacer u njegovoj arhivi različitih CRISPR regija tražio podudarnost s već postojećom sekvencom iz javne baze podataka. Njegova potraga na početku nije davala rezultat jer prije gotovo 20 godina baze genomskih sekvenci nisu bile bogate kao danas. Na svu sreću, Mojica nije odustao, a baza se neprestano nadopunjavala tako da je ovaj poduhvat polučio uspjeh.
Prvi spacer za koji je pronašao podudaranje pripada CRISPR regiji izoliranoj iz jednog soja bakterije E. coli. A odgovarajuća podudarna sekvenca pripada genomu bakteriofaga imena P1. Bakteriofag (skraćeno, fag) je tip virusa koji napada bakterijske stanice. No to nije sve – upravo taj soj bakterije E. coli je otporan na faga P1. To znači da fag P1 može inficirati i samim time ubiti neke druge sojeve, ali ove stanice to neće dopustiti.
Druge sekvence su pokazale slično podudaranje: sada je očito da spaceri imaju iste sekvence kao bakteriofazi ili plazmidi. Također, ispada da su bakterije iz kojih su ti spaceri izolirani nekako povezani s njima. Možda je neobično što u priču uz bakterijske viruse ulaze i plazmidi – ali postoje plazmidi sa informacijama za štetne proteine koji mogu ubiti bakterijsku stanicu.
Mojica je zaključio da je CRISPR regija odgovorna za zaštitu bakterija i arheja od različitih infekcija, poput neke bakterijske inačice stečenog imunosnog sustava. Ipak, za to nam nedostaje neki eksperimentalni dokaz.
Za sve je kriv jogurt
U ovom djelu priče upoznajemo Philippea Horvatha, biologa koji je svoj doktorat posvetio istraživanju bakterija mliječno-kiselinskog vrenja kojima možemo biti zahvalni za sarmu kakvu poznajemo. On se zaposlio u prehranbenoj industriji u mjestu Dangé-Saint-Romain na zapadu Francuske kao voditelj molekularno-biološkog laboratorija.
Firma u kojoj je Horvath bio zaposlen bavila se proizvodnjom mliječnih proizvoda. U procesu proizvodnje sireva i jogurta glavnu ulogu igraju bakterije, tako da je cilj svakog postrojenja da te bakterije ostanu zdrave i spremne za posao. Tako je Horvathov zadatak bio razviti metode za identifikaciju različitih sojeva bakterije Streptococcus thermophilus i bakteriofaga koji ju napadaju.
CRISPR regija genoma je Horvathu odlično poslužio za jednostavnu genotipizaciju sojeva S. thermophilus. Naime, samo pomoću razlika u sekvenci CRISPR regije mogao je uspješno razlučiti sojeve. Za taj neobičan dio genoma saznao je na jednoj konferenciji 2002. godine. Ali kroz nekoliko godina istraživanja, utvrdio je korelaciju između fagova na koje su rezistentni njegovi sojevi i sekvenci spacer regije. Došao je do sličnog zaključka kao i Mojica u to vrijeme, ali je odlučio napraviti jedan korak dalje.
Horvath je 2005. godine sa kolegama odlučio eksperimentalno pokazati da CRISPR regija ima svojstvo stečenog imunosnog sustava bakterija. Za eksperiment su koristili dva različita tipa bakteriofaga i soj bakterije S. thermophilus koji je podložan njihovom napadu. Nakon infekcije, cilj je bio izolirati stanice koje su ipak uspjele preživjeti.
Istraživači su napravili usporedbu CRISPR regije genoma tih rezistentnih bakterija prije i poslije susreta s bakteriofagima. Uočili nešto veoma zanimljivo: rezistentne bakterije su upravo tom prilikom zadobile dio sekvence genoma faga kao svoj spacer. Štoviše, veći broj ponavljanja sekvence faga u CRISPR regiji ukazuje na veću otpornost bakterije na infekciju. Bio je to dokaz koji su tražili.
Pokus su ponovili i u obrnutom redoslijedu: zanimalo ih je mogu li neki bakteriofazi izbjeći imunitet koji je pohranjen u CRISPR regiji. Uspostavilo se da je to moguće, i da je dovoljna mutacija genoma tih faga u samo jednom nukleotidu. Iz toga su zaključili da je stečeni imunitet za koji je zadužen CRISPR ovisan upravo o izuzetno preciznom podudaranju u genu napadača i sekvenci spacera.
Neke druge škare
Još jedna nepoznanica koju su odlučili ispitati su oni neobično cas geni. Preciznije, zanimali su ih geni cas7 i cas9. U genetici, geni se obično označavaju malim početnim slovom i u kurzivu – njih možemo očitati iz sekvence genoma. Geni nose informaciju za proizvodnju proteina, a proteini su aktivni sudionici u životu stanice. Prema konvenciji, ime proteina se piše velikim početnim slovom.
Ispostavilo se da je Cas7 važan za dodavanje novih spacera u CRISPR regiju, ali da nije važan za sam imunitet u akciji. Tu na svjetlo pozornice dolazi protein Cas9. On pripada skupini nukleaza, enzimima koji mogu rezati nukleinske kiseline, DNA i RNA (u istu tu skupinu pripadaju restrikcijski enzimi sa početka). Zbilja je prikladno nazvati taj protein molekularnim škarama. Istraživači su pokazali kako je upravo Cas9 aktivni sudionik bakterijskog imunosnog sustava.
Naravno, priča o razvoju CRISPR-Cas9 tehnologije ovdje ne staje. Tek nakon ovih otkrića možemo pratiti njezin razvoj i primjenu i biotehnologiji. Još je mnogo koraka bilo potrebno da bi se ovaj bakterijski imunosni sustav prilagodio jednoj sasvim drugoj namjeri. A više o tome u sljedećem nastavku.
Hvala što ste pročitali prvi nastavak naše priče o CRISPR-u. Kako vam se svidjelo? Veselite li se idućem dijelu? Javite nam!
Izvori
Lander ES. The Heroes of CRISPR. Cell. 2016 Jan 14;164(1-2):18-28. doi: 10.1016/j.cell.2015.12.041. PMID: 26771483.
Slika: Ganapathiraju, M.K et al. A reference catalog of DNA palindromes in the human genome and their variations in 1000 Genomes. Hum Genome Var 7, 40 (2020). https://doi.org/10.1038/s41439-020-00127-5