? 7 min
U prethodnom članku, krenuli smo otkrivati što se sve krije pod nazivom CRISPR-Cas9. Ideja ove serije priča o CRISPR-u je da zavirimo u pozadinu ove tehnologije za precizno uređivanje genoma. Zbilja je zanimljivo kako je jedan neobičan fenomen zapažen kod bakterija poslužio kao inspiracija za daljnja otkrića i razvoj biotehnologije. Naravno, ništa od toga ne bi bilo moguće bez međusobne suradnje znanstvenika diljem svijeta.
Kratki podsjetnik na zadnji dio
Naučili smo kako je uopće došlo do otkrića CRISPR regije genoma i koje su njezine karakteristike. Ona je specifična po izmjenama kratkih palindromskih sekvenci sa spacer sekvencama koje odgovaraju dijelovima genoma različitih bakteriofaga. Također, definirali smo cas gene koji su usko povezani sa CRISPR regijom i izdvojili zanimljiv protein Cas9 koji spada u skupinu nukleaza, što znači da može cijepati nukleinske kiseline (među tu skupinu molekula spadaju RNA i DNA). Na kraju, opisali smo sam eksperiment kojim je otkriveno da CRISPR regija ima ulogu stečenog imunosnog sustava bakterija.
Danas ćemo napraviti još jedan korak dalje: objasnit ćemo kako taj „bakterijski imunitet“ zapravo funkcionira na molekularnoj razini.
Ništa bez RNA
S obzirom na to da bakteriofazi ili plazmidi predstavljaju potencijalnu opasnost za bakterijsku stanicu, mora postojati neki način na koji informacija zapisana u CRISPR regiji genoma postaje aktivni sudionik u borbi protiv njih. Naime, genetička informacija sadržana u CRISPR regiji (u vidu niza nukleotida DNA) ne može postići mnogo sama po sebi. Trebaju nam neke druge molekule koje će obaviti aktivni dio posla, inače bi CRISPR regija bila poput pisma koje nitko neće pročitati. Sada je važno prisjetiti se procesa transkripcije, tj. prevođenja DNA u RNA.
Zašto je RNA važna molekula u ovom djelu priče? Kao što smo prethodno otkrili, unutar CRISPR regije nalaze se spacer sekvence koje su jednake dijelovima genoma različitih bakteriofaga i plazmida. Ako je RNA komplementarna lancu DNA spacer sekvence neke bakterije, onda je ona komplementarna upravo i DNA bakteriofaga koji napada tu bakterijsku stanicu. Zapamtite ovu ideju o komplementarnosti između DNA i RNA, trebat će nam za kasnije objašnjenje.
A rezultat prepisivanja je…
Vrijeme je da posjetimo Nizozemsku i upoznamo Johna van der Oosta, znanstvenika koji je 1995. godine počeo raditi na nizozemskom Sveučilištu u Wageningenu. Inicijalno, cilj njegovog projekta bio je istražiti metabolizam ekstremnofilnih arheja koje obitavaju u nacionalnom parku Yellowstone. Jedan od suradnika na projektu bio je Eugene Koonin čije su područje interesa bili upravo različiti CRISPR sustavi koji se mogu pronaći kod različitih bakterijskih vrsta. Naime, CRISPR sustavi su veoma raznoliki diljem bakterijskog carstva. Generalno, klasificiraju se u dvije glavne klase, ovisno o tome koliko Cas proteina obavlja ulogu molekularnih škara. Zadnji put smo upoznali CRISPR sustav bakterije S. thermophilus kod koje je posao nukleaze obavljao samo protein Cas9. Izgleda da je i van der Oosta to područje iznimno zainteresiralo jer je 2005. odlučio prebaciti dio financija upravo na istraživanje CRISPR-a.
Znanstvenici su 2008. proveli jedan zanimljiv eksperiment na CRISPR sustavu bakterije E. coli. Naime, u tom eksperimentu, oni su doslovno promatrali što se događa sa RNA molekulom koja se prepisuje sa CRISPR regije genoma. Shvatili su da je kod E. coli čak pet različitih nukleaza potrebno da prepisanu RNA molekulu pocijepaju na kraću molekulu RNA koja se zove CRISPR RNA ili, kraće, crRNA.
Sekvencianjem su otkrili da te crRNA započinju sa zadnjih osam nukleotida onih palindromskih sekvenci CRISPR regije, nakon čega slijedi jedna čitava spacer sekvenca, te početak sljedeće palindromske sekvence. To je jako bitna informacija koja nam može otkriti više o samoj strukturi crRNA: palindromske sekvence će se moći povezivati i tvoriti sekundarne strukture te ulaziti u interakciju s drugim molekulama.
Još jedno važno postignuće istraživačke skupine van der Oosta je prvo programiranje CRISPR regije. Oni su u nju doslovno, kao spacere, ubacili gene bakteriofaga λ – i to u pažljivo odabrani soj bakterija koji je podložan infekciji tim fagom. Jasno, rezultati su pokazali da se na taj način može postići rezistencija na zarazu.
Tako maleno, a tako precizno
U prošlom nastavku smo opisali eksperimente istraživačkog tima Philippea Horvatha kojim su pokazali da je CRISPR regija zadužena za neku vrstu bakterijskog imunosnog odgovora. Jedan od njegovih suradnika bio je Sylvain Moineau. Nekoliko godina nakon njihovog zajedničkog otkrića 2010. on je i dalje ostao zainteresiran za to područje. Ovaj put ga zanima ga kako zapravo dolazi do tako preciznog rezanja DNA bakteriofaga ili plazmida koji napadaju bakterijsku stanicu.
Bakterije koje je njegov istraživački tim proučavao pripadaju vrsti S. thermophilus. Pokušavali su provesti transformaciju tih bakterija uvođenjem strane DNA u obliku plazmida metodom elektroporacije kako bi bolje proučili proces uništavanja te strane DNA unutar stanice. Na žalost, bilo je veoma komplicirano izolirati bilo koji međuprodukt te reakcije jer čitav proces razgradnje strane DNA odvija doista brzo. Ipak, uskoro su među njihovim bakterijama uspjeli izolirati soj koji nije toliko efikasan u uništavanju potencijalnog neprijatelja, što se pokazalo izvrsnim za njihove potrebe. U tom soju, u citoplazmi su zaostali tek iscijepani plazmidi koje je bilo moguće sekvencionirati.
Rezultati sekvencioniranja su doveli do sljedećeg otkrića: svi plazmidi su presječeni točno tri nukleotida od sekvence koja se danas naziva PAM sekvencom (skraćeno od proto-spacer adjacent motif). Kada su ponovili taj pokus sa virusnom DNA, rezultat je bio sličan: DNA se ponovno cijepa na istoj udaljenosti od PAM sekvence. U istoj seriji eksperimenata, uspjeli su pokazati da se strana DNA cijepa na onoliko mjesta koliko postoji njoj jednakih spacer sekvenci u CRISPR regiji bakterije. Dakle, crRNA prepisana sa CRISPR regije genoma je svakako izuzetno bitan posrednik koji pruža informaciju o tome gdje će se Cas9 (ili neka druga nukleaza, ovisno o bakterijskoj vrsti) pocijepati stranu DNA.
Stiže i druga RNA
Još smo na početku rekli da će nam u ovom članku molekule RNA biti vrlo važne. Sada je vrijeme da upoznamo znanstvenike Emanuelle Charpentier i Jörga Vogela, čije su područje istraživanja upravo bakterijske RNA, neovisno o CRISPR-u. Charpentier je bila u potrazi za novim vrstama regulatornih molekula RNA te je bioinformatičkom analizom regija genoma bakterije S. pyogenes koje ne nose informacije za sintezu proteina došla do regije blizu CRISPR lokusa. U toj regiji se potencijalno krila nova RNA. Charpentier je 2007. godine započela suradnju s Vogelom koji je napravio sekvencioniranje transkriptoma bakterije S. pyogenes. Transkriptom predstavlja sve molekule RNA koje će se prepisati iz nekog genoma.
Od svih vrsta RNA koje su dobili sekvenciranjem transkriptoma, upravo ta neobična vrsta RNA koja se prepisuje s lokusa u blizini CRISPR regije genoma je treća najzastupljenija u čitavom transkriptomu. Danas se ta molekula RNA naziva i tracrRNA. Još jedna zanimljivo otkriće vezano uz tu vrstu RNA jest da se u 25 nukleotida komplementarna sa palindromskim sekvencama iz CRISPR regije. Ovaj put, komplementarnost upućuje na međusobno spajanje crRNA i tracrRNA na tom djelu. Kasnijim eksperimentima je pokazano da je tracrRNA doista važna za procesiranje molekula crRNA koje se prepisuju sa CRISPR regije genoma.
Imamo sve komadiće slagalice
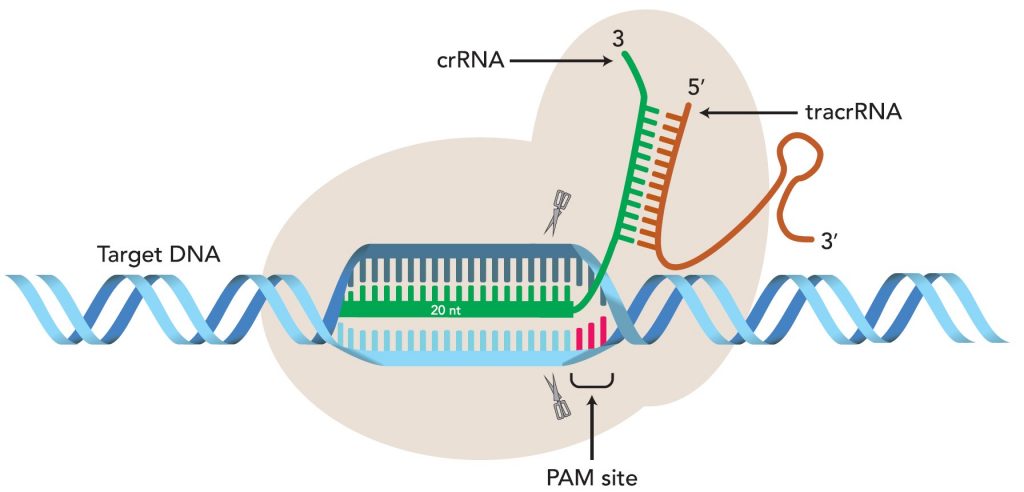
Sada smo polako skupili sve dijelove jednog CRISPR sustava: imamo crRNA, tracrRNA i jedan ili više Cas proteina koji imaju ulogu nukleaze. Naravno, potreban nam je dio genoma u kojem je pohranjena informacija za „proizvodnju“ svih ovih dijelova unutar same stanice. Ali, zašto ove dijelove CRISPR sustava ne bismo proizveli in vitro, i ubacili u neku bakteriju?
Upravo ta ideja je pala na pamet Virginijusu Siksnysu, litvanskom kemičaru koji je u Vilniusu odlučio proučavati restrikcijske enzime. S obzirom na to da je najbitnija funkcija CRISPR sustava upravo rezanje molekule DNA (što je upravo ono što restrikcijski enzimi rade), ovo područje ga je veoma zainteresiralo.
Cilj istraživanja njegovog tima bio je ispitati može li se funkcionalan CRIPSR sustav jedne bakterijske vrste rekonstruirati u nekoj drugoj bakterijskoj vrsti. U eksperimentu su premjestili CRISPR lokus bakterije S. thermophilus u E. coli i pokazali da je doista djelotvoran. Podsjećam, bakterijama vrste E. coli je inače potrebno pet molekula da pocijepaju stranu DNA, ali ovime su pokazali da je nukleaza Cas9 jedina koja je potrebna, čak i u drugoj bakterijskoj vrsti.
Ovo je vrlo važan korak za daljnji razvoj CRISPR-Cas9 tehnologije jer je doista pokazano da su isključivo nukleaza Cas9, tracrRNA i crRNA potrebne za cijepanje strane DNA, neovisno o vrsti bakterije. Sada smo napokon spremni za još uzbudljiviji dio – kako su ovu spoznaju znanstvenici iskoristili za potrebe genetičkog inženjerstva.
Više o tome u sljedećem nastavku!
Izvori
https://microbenotes.com/dna-transcription-rna-synthesis/
Izvor slike: https://hackmd.io/@aphanotus/bi332f19