? 26 min
“Naša primarna misija je kritična za život. Naš cilj je vrlo jasan: apelirati na ogromne nejednakosti u zdravlju djece koje i dan danas postoje u svijetu. Život ili smrt mladog djeteta prečesto ovisi o tomu da li je ono rođeno u zemlji u kojoj su cjepiva dostupna.”
Nelson Mandela, prilikom obraćanja Vaccine Fund Board-u 2003 na sastanku u Johannesburgu
Posljednja tema u seriji o medicinskim istraživanjima i kliničkim studijama je povezana sa studijama koje proučavaju cjepiva, i koji bolji primjer dati nego objasniti cijeli proces na nedavnoj COVID-19 pandemiji. Poput drugih farmaceutskih proizvoda, studije na cjepivima se odvijaju u 3-4 faze (Faze I-III prije dolaska na tržište i Faza IV nakon što je cjepivo odobreno).
U stvarnosti, cjepiva mogu biti preventivna (korištena za prevenciju bolesti) i terapetutska (korištena za liječenje postojeće bolesti). Cijepiti se mogu zdrave osobe ili pacijenti koji imaju određenu bolest, ovisno o dizajnu i samoj bolesti. Cjepiva se mogu davati na više načina, intramuskulano (u mišić), potkožno, a postoje i oralna i nazalna cjepiva. Također, novijim tehnologijama se proučava primjena transdermalnih flastera kao način dostave cjepiva, kako bi se izbjegla nelagoda povezana s injekcijom. Cjepiva se najčešće injektiraju putem igle, no takva injekcija može biti već pripremljena s točnom dozom cjepiva, ili može doći u bočici, koja se prvo mora pripremiti u odgovarajućoj dozi prije primjene.
Kada govorimo o cjepivima, najčešće mislimo na cjepiva koja sprečavaju zarazne bolesti – one koje se mogu prenijeti s osobe na osobu. Primjer su infektivne bolesti s patogenim agentima kao uzrocima: kolera, tifus, hepatitis, gripa (influenca), malarija, tuberkuloza, tetanus i COVID-19. Nasuprot zaraznim bolestima, neprenosive bolesti su tipično kronične bolesti u pojedincu kao što je karcinom, kardiovaskularne bolesti i dijabetes. One ne mogu biti prenesene s osobe na osobu preko tjelesnih tekućina, udisanjem virusa ili putem ugriza insekta.
U ovom članku, zbog jednostavnosti, fokusirat ćemo se na preventivna cjepiva i zarazne bolesti. Prethodni članak već sadrži općenito objašnjenje o tome kako se provode klinička istraživanja, što je također primjenjivo velikim dijelom i na cjepiva.
Klinička istraživanja cjepiva: po čemu su posebna u odnosu na druge studije?
Imunost
Kao što je objašnjeno gore, zarazne bolesti uzrokuju patogeni agenti – virusi, bakterije, gljivice ili paraziti. Svaki patogen je biološki i kemijski različit od drugih, npr., bakterija je bitno drukčija od virusa a gljivice su bitno drukčije i od bakterije i od virusa. Jednom kad naša tijela suoče s patigenom prvi put, reagirat ce na dijelove patogena tako što će početi stvarati antitijela. Dio patogena koji je zaslužan za takvu reakciju i za stvaranje antitijela se zove antigen. Kako proizvodnja antitijela nije trenutna, tijelo u početku postane bolesno i inače je to vrijeme kad se razvijaju prvi simptomi bolesti. Međutim, kako se antitijela proizvode, sljedeći put kada se suočimo s istim antigenom, naše tijelo će ga moći prepoznati jer ima razvijenu imunost da spriječi istu bolest i simpome koje ju prate.
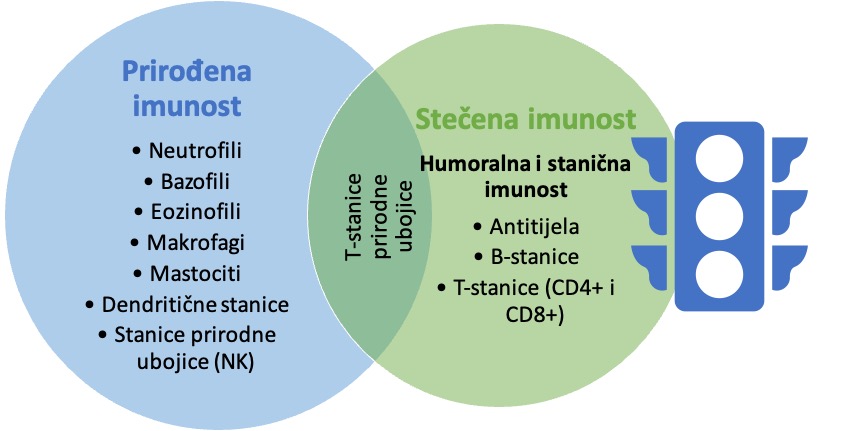
Imunosni sustav je složena platforma i postoje dodatni dijelovi koji pridonose općenitoj zaštiti zajedno s antitijelima. Imunost u svojoj srži može biti prirođena ili stečena. Prirođena imunost je imunost s kojom smo rođeni, s organima, tkivima i stanicama koje nas štite (npr. koža, bijela krvna zrnca), dok je stečena imunost ona koja se stječe tijekom života. Stečena imunost može biti aktivna (priodno stečena kad se suočimo s patogenima ili umjetno preko cjepiva) i pasivna (prirodno stečena preko nekog drugog, npr. od majke putem dojenja ili umjetno stečena preko lijeka, npr. infuzija s antitijelima). Cijepljenje, kao takvo, nudi prečicu za stjecanje stečene imunosti protiv određenog patogena prije nego što se s njim susretnemo po prvi put, i sa sobom češće nosi manje nuspojava i neugodnosti nego sama bolest.
Sastojci cjepiva // vrste cjepiva // doze
Cjepiva mogu sadržavati razne sastojke i mogu biti dana u jednoj ili više doza, ovisno o putu stečenog imunosnog sustava kojeg moraju aktivirati i moraju li imati sposobnost dugoročne zaštitite tijekom vremena.
Kao primjer, influenza ili virus gripe je jedan od patogena za kojeg je vrlo teško razviti univerzalno cjepivo koje bi štitilo općenito od gripe, bez obzira na sezonske promjene virusa. Problem u razvoju takvog univerzalnog, “suprasezonskog” cjepiva, u suprotnosti sa sezonskim cjepivom, leži u biologiji samog virusa. Virus gripe se sastoji od 8 segmenata jednolančane RNK/RNA molekule – što je njegov genetski materijal, i kada jednom zarazi stanicu, svaki virus oslobodi svojih 8 segmenata unutar stanice, gdje proizvodnja novih virusnih čestica započinje. Prilikom tog proces, mogu se dogoditi veće ili manje greške:
- Antigenski “drift” – pomak: proizvodnja je puna grešaka prilikom čega nastaju mutacije u novonastalim RNA segmentima koje se nasumično pakiraju u nove virusne čestice. Ti RNA segmenti u končnici služe kao obrazac za proizvodnju nekoliko enzima i proteina koji na poslijetku prozivode 2 glikoproteina na površini virusa: hemaglutinin (HA) i neuraminidazu (NA). HA i NA predstavljaju antigene protiv kojih će tijelo stvoriti antitijela. Virus koristi HA kako bi ušao u stanicu i NA kako bi izašao iz stanice kada nastanu nove virusne čestice i kada je virus spreman za širenje. Vjerojatno ste upoznati s H1N1 – ta slova dolaze od dva spomenuta proteina (brojevi označavaju različite HA i NA tipove, koji mogu biti mnogobrojni, u, npr. pticama, dok su ograničeni u čovjeku na nekoliko). Tijekom vremena, te male mutacije se mogu nakupiti i rezultirati u drukčijim HA i NA na površini, i zbog toga, antigenski, virus biva previše različit od originalnog s kojima su naša antitijela upoznata. Naš imunosni sustav stoga možda ne bi mogao prepoznati takav virus jer je previše promijenjen. Zbog takvih pomaka se razbolijevamo od gripe nekoliko puta tijekom života.
- Antigenski “shift” – izmjena: ponekad nastaju velike promjene, rezultirajući u novim HA i NA nepoznatim čovjeku. Često, to se dogodi kada životinjski virus postane sposoban zaraziti čovjeka. Poznati slučaj je svinjska gripa iz 2009. kada su se ptičji, ljudski i svinjski virusi izmiješali i postali sposobni zaraziti čovjeka.
Ovi razlozi mogu biti primjer zbog čega je teško razviti univerzalno, višegodišnje cjepivo, uvjetovano učestalim i godišnjim promjenama virusa. Unatoč tomu, razne tvrtke/sponzori pokušavaju razumjeti dublje biologiju gripe i pronalaze nove tehnologije i nove dijelove virusa koji mogu pomoći u postizanju robusnijeg cjepiva protiv gripe.
Dijelovi cjepiva
Ono što je važno za cjepiva je da aktiviraju imunosni sustav u tijelu. Da bi de to postiglo, svako cjepivo mora sadržavati barem jednu ili više komponenti odgovornih za izazivanje željenog učinka:
- Antigen
Svako cjepivo sadrži dio koji aktivira imunosni sustav kako bi tijelo moglo prepoznati opasnost sljedeći put kad se susretne s istim patigenom i spriječiti bolest. Najčešće je to mali dio patogena (bakterije ili virusa) ili može biti i oslabljeni oblik patogena, koji će izazvati reakciju imunosnog sustava ali ne i bolest.
- Konzervansi
Konzervansi pomažu zaštiti cjepivo od kontaminacija. Neka cjepiva su pakirna u bočicama ili injekcijama za jedno korištenje, tako da se daju jednoj osobi. Takva cjepiva ne moraju nužno sadržavati konzervans. Međutim, bočice koje sadrže više doza za više ljudi moraju biti sigurna za višestruko korištenje i konzervansi služe kako bi spriječili kontaminaciju jednom kad cjepivo dođe u kontakt sa zrakom. 2-fenoksietanol je često korišten konzervans, dokazano siguran za korištenje u cjepivima i drugim proizvodima, jer ima nisku toksičnost u ljudima.
- Stabilizatori
Stabilizatori se koriste kako bi spriječili neželjene kemijske reakcije u bočici i mogu biti šećeri, proteini, želatina ili aminokiseline.
- Surfaktanti (površinski aktivne tvari)
Surfaktanti čine cjepiva homogenima i jednoličnima, jer sprječavaju nakupljanje tvari. Često se koriste i u industriji hrane, npr., u sladoledima.
- Reziduali (sastojci u tragovima)
Reziduali su tvari prisutne u jako malim količinama (mjerenima u dijelovima na milijun ili milijarde) u cjepivima kao ostatak procesa proizodnje. Na primjer, sezonsko cjepivo protiv gripe se proizvodi u jajima, zbog čega konačno cjepivo može sadržavati proteine jaja u tragovima, no u toliko malim količinama da je sigurno za primjenu u osobama alergičnim na jaja.
- Sredstvo za razrjeđivanje (diluent)
Općenito, cjepiva moraju biti u određenim koncentracijama koje su definirane točnom dozom za primjenu. Cjepiva su ili odmah pripremljena u točnoj koncentraciji ili se prvo moraju pripremiti. Kako bi se postigla željena koncentracija, diluenti ili sredstva za razrjeđivanje se koriste. Najčesće korišteno sredstvo je fiziološka otopina.
- Adjuvans (pomoćno sredstvo)
Uz antigen, cjepivo može sadržavati i druge aktivne dijelove kako bi se pojačalo djelovanje ili potencija. Ti dijelovi su pomoćne tvari ili adjuvansi i koriste se kako bi poboljšali imunosni odgovor nakon cijepljenja, stimulirajući lokani imunosni sustav ili dijelove stanične imunosti. Često korišten adjuvans je na bazi aluminijevih soli, ali postoje i druge, složenije platforme. Posebno važno je istaknuti da se aluminij može pronaći u hrani i našem okolišu i da je količina korištena u cjepivima potpuno sigurna za ljude.
Kako se cjepiva proizvode?
Početna doza i raspored
Cjepiva, poput drugih farmacutskih medicinskih proizvoda, su razvijena na temelju pretkliničkih i kliničkih istraživanja, kao što je opisano u Dijelu 1 i 2 ove serije članaka (Klinička istraživanja – Prvi dio: Medicinska istraživanja i Klinička istraživanja – Drugi dio: Klinička istraživanja). Jedan od glavnih izazova s razvojem cjepiva, za razliku od lijekova, je određivanje početne doze, zbog nedostatka primjerenih modela. Cjepiva su biološki proizvodi, pa toksičnost, farmakodinamika i farmakokinetika, kao takvi, nisu uvijek prikladne mjere za uspostavljanje doze. Uz to, preporuke regulatornih rijela za uporabu cjepiva “prvi put u čovjeku” (engl. “First Time in Human” (FTiH)) su nepotpune i često nejasne. Preporuke i EMA i FDA za kliničke studije “prvi put u čovjeku” su fokusirane na medicinske proizvode općenito, nevezano jesu li biološki, biotehnološki ili kemijski proizvodi. Međutim, cjepiva dolaze sa svojim posebnostima kao predstavnici bioloških prozivoda i trenutno ne postoji jasna preporuka o odabiru početne doze za kliničku uporabu. ICH nudi vrlo općenite smjernice.
Za početnu dozu lijekova koristi se pristup zasnivan na toksičnosti u primjerenim životinjskim modelima. Takav pristup se zasniva na neuočavanju nuspojava (engl. no-observed-adverse-effect level (NOAEL)). Kako su cjepiva složena u smislu izlaganja i dugoročnog učinka, kao i nespecifičnih nuspojava, NOAEL možda nije najprimjereniji izbor metode određivanja početne doze. Alternativna metoda se zasniva na minimalnom očekivanom biološkom učinku (engl. minimal-anticipated-biological-effect level (MABEL), koja rezultira dozom pri kojoj se minimalni biološki učinak očekuje na temelju in vitro i in vivo podataka. Zasniva se na prisutnosti bilo kakvog biološkog učinka, ne samo toksičnosti, i samim tima često resultira nižom dozom u usporedbi s NOAEL metodom. No čak i kad biološki učinak postoji, problem s cjepivima je što je i dalje nepoznato je li taj učinak dovoljan za zaštitu protiv bolesti, posebice ako stupanj korelacije potreban za kliničku zaštitu (engl. correlate of clinical protection) nije poznat. Stupanj korelacije potreban za kliničku zaštitu = razina za koju znamo/očekujemo da je dostatna kako bi cjepivo štitilo, tako što će spriječiti patogen da uđe u stanicu i replicira se ili tako što će spriječiti pojavu simptoma i oslobađanje virusa (time zarazujući druge ljude).
Ukoliko je novo cjepivo razijeno protiv bolesti za koju već postoji cjepivo, sam razvoj bi bio olakšan, jer bi postojao način za usporedbu novih rezultata s prethodno uspostavljenom sigurnošću, učinkom i imunogeničnosti. Ukoliko cjepivo protiv određene bolesti ne postoji, koristi se pristup koji se temelji na procjeni rizika. Ono što također može pomoći je upotreba životnjskih modela, sve dok su oni što je moguće sličniji čovjeku, dok se mogu zaraziti istim patogenom prirodnim putem i sve dok imaju slične simptome bolesti. To je vrlo dug i složen proces, koji uključuje kliničke i nekliničke aspekte. Osim početne doze, također je potrebno ustanoviti hoće li moguće cjepivo imati trajan učinak ili samo kratkotrajan iziskujući ponovljeno doziranje (booster). Ovisno o tome, nekoliko raznih doza i rasporeda se mogu testirati u Fazi I/II kliničkog ispitivanja.
Izuzevši složenost, ono što je ohrabrujuće je da se cjepiva smatraju vrlo sigurnim proizvodina. Nuspojave koje su otkrivene tijekom kliničkih ispitivanja su često blage i kratkotrajne. Međutim, zabilježeni su rijetki slučajevi s težim nuspojavama, čak i smrti. Primjeri su:
- 1955. dogodio se Cutter incident s izbijanjem polio infekcije kada su nedostatno inaktivirane skupine polio cjepiva uzrokovale izbijanje polio infekcija zbog prisutnosti divljeg soja poliovirusa. 40,000 djece se zarazilo poliovirusom, doduše s blagim simptomima, dok je 200 ostalo trajno paralizirano i 10 je umrlo od posljedica.
- 1967., u 4 kliničke studije koje su ispitivale cjepivo protiv respiratornog sincicijskog virusa (RSV) novorođenčad i mala djeca koja su bila imunizirana s formalin-inaktiviranim cjepivom razvila su pojačani oblik RSV bolesti okarakterizirane s visokom temperaturom, bronhopneumonijom i hroptanjem nakon što su se zarazili s divljim sojem RSV virusa. Hospitalizacije koje su uslijedile su bila brojne i dvoje male djece je preminulo. U ovom slučaju, umjesto da je cjepivo štitilo od bolesti, dovelo je do dotad nepoznate pojačane respiratorne bolesti uzrokovane cjepivom (engl. VAERD (vaccine-associated enhanced respiratory disease)). Ovaj fenomen je bio zabilježen jedino u djeci koja su bila cjepljena prije nego što su se inficirala RSV-jem (seronegativna djeca). Inače se ljudi RSV-jem zaraze u prosjeku do druge godine života. Do danas, ovo predstavlja problem u razvoju cjepiva za seronegativnu djecu, koja je najranjivija populacija u smislu infekcije RSV-jem.
- Nedavno, kako je COVID-19 pandemija započela u ožujku 2020. i nekoliko cjepiva protiv SARS-CoV-2 su razvijena, mediji su prenosili danonoćna izvješća o nuspojavama cjepiva. Iako su bile vrlo rijetke, ozbiljne nuspojave i smrtni slučajevi su zabilježeni. Takve nuspojave, iako neučestale, se još uvijek proučavaju i znanstvenici pokušavaju saznati mogući mehanizam djelovanja kako bi razvili još sigurnija cjepiva.
U mnogim slučajevima, priodna bolest može prouzrokovati više nelagode, dugoročnih simptoma, pa čak i smrt. To je, naravno, bitno kada se određuje profil ravnoteže između rizika i prednosti (engl. risk/benefit profile). Uz to što se promatra ravnoteža između rizika i prednosti na razini pojedinca, zbog toga što cjepiva sprečavaju zarazne bolesti, kolektivni imunitet ili “imunitet krda” su također važni čimbenici – da li određena razina procjepljenosti u populaciji pruža opću zaštitu (možda ste recimo čuli na vijestima da “moramo postići određenu procjepljenost/imunitet krda” za zaštitu). Zato je važno razumjeti da prednost na razini velike populacije ili kolektiva može biti važnija u procjenama od rizika na razini pojedinca kada se proučavaju ishodi i ravnoteža između rizika i prednosti.
Ciljevi/parametri kliničkih ispitivanja na cjepivima
Nuspojave izazvane cjepivima se mogu prikupljati i nadzirati ili unutar kliničkih studija ili u raširenoj primjeni nakon što je cjepivo odobreno za uporabu na određenom tržištu. Štetni događaji (engl. adverse event, AE) su bili kakve neželjene nuspojave povezane s korištenjem medicinskog proizvoda u osobi.
U kliničkim ispitivanjima, nakon cijepljenja, često se sljedeće grupe nuspojava prikupljaju od strane sudionika:
- Predviđene nuspojave ili reaktogenost – skupina unaprijed određenih nuspojava prikupljenih nakon svakog cijepljenja tijekom kratkog vremena, jer se očekuje da su kratkotrajne – obično se prikupljaju u obliku dnevnih upitnika kako bi se ustanovilo prisutstvo ili odsustvo:
- Lokalnih predviđenih nuspojava: bol/osjetljivost na mjestu uboda injekcijom koja sadrži cjepivo; crvenilo/eritem; oteklina
- Sistematskih predviđenih nuspojava: glavobolja, bolovi u mišićima (mijalgija), bolovi u zglobovima (artralgija) probavne smetnje/proljev/mučnina, povišena tjelesna temperatura, umor
Na primjer, sudionik u studiji može biti zamoljen da zabilježi prisutstvo glavobolje i boli na mjestu uboda svaki dan tijekom 10 dana nakon cijepljenja u svom dnevniku nuspojava.
- Nepredviđene nuspojave – svaka nuspojava koja nije ozbiljna bi se trebala zabilježiti unutar specifičnog vremenskog perioda, npr., bol u leđima koja započinje 15 dana nakon cijepljenja.
- Ozbiljne nuspojave – svaka neželjena nuspojava koja rezultira:
- Smrću,
- Je opasna po život,
- Hitnom intervencijom ili hospitalizacijom, izuzevši neobavezne/elektivne operacije,
- Trajnom ili značajnom invalidnosti/nesposobnosti,
- Urođenim nepravilnostima/nasljednim bolestima,
- Zahtjeva intervenciju kako bi se spriječilo trajno oštećenje.
Ovakve nuspojave se najčešće prikupljaju tijekom cijele studije.
Često, nuspojeve koje zahtijevaju posjet liječniku (engl. medically-attended AEs (MAAEs)), i bolesti potencijalno posredovane imunološkim mehanizmima (engl. potential immune-mediated diseases (pIMDs)) se također prikupljaju tijekom studije. Svaka nuspojava može imati različitu razinu štetnosti, koja se standardno određuje prema FDA Toxicity Grading Scale for Healthy Adult and Adolescent Volunteers Enrolled in Preventive Vaccine Clinical Trials. Blage nuspojave koje ne utječu na svakodnevnu aktivnost pripadaju razini 1, one koje djelomično utječu na svakodnevicu su na razini 2 a one koje onesposobe sudionika za svakodnevne aktivnosti su na razini 3. Dodatno, za svaku nuspojavu, istraživači i sponzor mogu odrediti kolika je vjerojatnost da je štetni događaj povezan s cjepivom. Na primjer, netko tko je imao prometnu nesreću i zbog toga slomio nogu 3 dana nakon cijepljenja će prijaviti ovaj događaj unutar studije. Dok je slomljena noga štetni događaj, vrlo vjerojatno nije nuspojava cijepljenja, no sama prometna nesreća bi mogla biti ukoliko je do nesreće došlo zbog toga što je osobi pozlilo kao posljedica cijepljenja. Potrebno je uočiti da i rezultati laboratorijskih analiza prije ili nakon cijepljenja mogu biti promatrani zbog moguće promjene ili pogoršanja u broju stanica (trombociti, bijela krvna zrnca itd.).
Osim nuspojava, imunogenost se također često proučava na temelju uzoraka krvi: humoralna imunost (neutralizirajuća antitijela, memorijske B-stanice) i stanična imunost (T-stanice). Time se proučava ima li cjepivo sposobnost aktivranja imunosnog odgovora, ukazujući na moguću zaštitu od bolesti. Razine prije i nakon cijepljenja se proučavaju i na temelju promjene od polaznog uzorka, sljedeći koraci se određuju.
Sigurnost, reaktogenost i imunogenost, kao i izbor doze i rasporeda cijepljenja se zasnivaju na rezultatima kliničkih istraživanja, obično Faza I/II. Faza III općenito nastavlja istraživanje sigurnosti jer se velika količina ljudi izlaže cjepivu, ali također proučava i učinkovitost cjepiva, odnosno sposobnost cjepiva da nas zaštiti od bolesti. Općenito, promatra se koliko ljudi se zarazi nakon cijepljenja u grupi koja je primila aktivno cjepivo naspram grupe koja je primila placebo cjepivo. Druge studije u Fazi III mogu izučavati neinferiornost jednog cjepiva kada se daje u isto vrijeme s drugim cjepivom u usporedbi sa samostalnom primjenom, mogu se proučavati razlike između cjepiva koja su proizvedena istodobno naspram onih koja su proizvedena prije/poslije ili istek roka valjanosti, mogu se provesti nove studije u posebnim skupinama ljudi: trudnicama, djeci ili pojedincima s narušenim imunosnim sustavom.
Sve opisano predstavlja ciljeve i paremetre na čijem se temelju zasniva uspjeh kliničke studije, programa i samog cjepiva. Na poslijetku, tako se izučava ravnoteža prednosti i rizika za svako cjepivo, i ovisno o ishodu, cjepivo možda nikad neće biti odobreno za upotrebu na određenom trzištu.
Platforme za razvoj cjepiva
Kada govorimo o platformama na temelju kojih se današnja cjepiva razvijaju, moramo uzeti u obzir bolesti protiv kojih bi štitila, željeni imunološki odgovor, te praktičnost samog razvitka. Platforme mogu biti sljedeće:
- Inaktivirana cjepiva
Kada je patogen inaktiviran ili umrtvljen u laboratoriju toplinom, radijacijom ili kemikalijama i zatim korišten kao antigen u cjepivima, govorimo o inaktiviranom cjepivu. Primjeri su cjepiva protiv poliovirusa i gripe. Za takva cjepiva se zna da imaju djelovanje u čovjeku i mogu biti proizvedena na relativno razumnoj razini. Međutim kako se patogen mora proizvesti u laboratoriju na siguran način te zatim biti inaktiviran/umrtvljen, sam proces može oduzeti dostatan vremenski period. Sjetite se npr., da se virus gripe uzgaja u jajima, pa tako proteini jaja mogu biti residuali (u tragovima) takvih cjepiva. Često, takva cjepiva ne nude dugoročnu zaštitu, te su ponovljene doze (boosteri) potrebni.
- Živo, oslabljeno (atenuirano) cjepivo
Kada je patogen oslabljen, ali ne potpuno umrtvljen, mislimo na živa, oslabljena (atenuirana) cjepiva. Tehnologija je slična kao kod inaktiviranih cjepiva. Najbolji primjer su cjepiva protiv ospica, zaušnjaka i rubeole (i vodenih kozica) (engl. MMR(V) cjepiva – measles, mumps, and rubella (and varicella)). Kako sadrže oslabljeni, ali još uvijek živi virus, takva cjepiva nisu preporučljiva za korištenje u ljudima s oslabljenim imunitetom. Često pružaju dugoročnu zaštitu.
- Messenger RNA (mRNA) cjepiva – cjepiva bazirana na glasičkoj RNK molekuli
mRNA cjepiva su proučavana dugi niz godina i tek nedavno su prvi put uspješno proizvedena. Prednost takvih cjepiva je da ne sadrže živi organizam, nego samo genetski materijal – uputu kako stvoriti proteine antigene protiv kojih će imunosni sustav uspostaviti obranu. Njihova proizvodnja je vrlo jednostavna i brza, jer se zasniva na genetskoj sekvenci. Trenutno jedini dostupan primjer je cjepivo protiv COVID-19.
- Cjepiva bazirana na podjedinicama, polisaharidima, rekombinantna i konjugirana cjepiva
Ovakve vrste cjepiva sadrže dio patogena, npr., protein, šećer ili veće dijelove samog virusa/bakterije. Mogu se koristiti na svakome i pritom su sigurna čak i za one s osljabljenim imunitetom, Pritom, ponekad ne pružaju dugotrajnu zaštitu. Primjeri su cjepivo protiv pneumokoka i ljuskog papilomavirusa (HPV), itd.
- Toksoidna cjepiva
Toksoidna cjepiva se baziraju na toksinima/otrovima koje patigen luči i koji uzrojuju bolest. Imunosni sustav se tako aktivira u prisutnosti toksina, ne samog patogena. Ponovljena doza (booster) je potrebna kako bi se pružila odgovarajuća zaštita. Primjer je cjepivo protiv difterije/tetanusa.
- Vektorska cjepiva
Ove vrste cjepiva sadrže različit virus koji je prenositelj dijelova patogena koji uzrokuje bolesti. Takav patogen se doprema putem virusa vektora (prenositelja) u stanicu domaćina i time se potiče imunosni odgovor protiv patogena. Virus vektor je siguran i ne potiče razvijanje bolesti kao takav. Njegov cilj je da prezentira dijelove drugog patogena domaćinu kako bi tijelo moglo razviti zaštitu protiv tog virusa/bakterije. Cjepivo protiv ebole je primjer.
Kao što je spomenuto ranije, cjepiva mogu biti davana na razne načine, najčesće se injektiraju u potkožno tkivo ili mišić. Neka postojeća cjepiva se mogu dati intranazalno (sprej za nos – cjepivo protiv gripe) ili oralno (kapi za usta – cjepivo protiv rotavirusa).
COVID-19 vaccine development
Donedavno, javnost nije bila detaljno izložena pretkliničkim i kliničkim isttaživanjima lijekova i cjepiva. To se u potpunosti promijenilo 2020. godine. U prosincu 2019., novi virus se pojavio u Wuhanu u Kini i otada se proširio po cijelom svijetu. 11. ožujka 2020, godine, proglašena je pandemija. Zaključno s 10. travnja 2022., pandemija je uzrokovala 497 milijuna COVID-19 slučajeva i 6.17 milijuna slučajeva sa smrtnim ishodom, čineći ju jednom od najsmrtonosnijih u povijesti dosada.
Odmah po proglašenju pandemije, nekoliko tvrtki je započelo razvoj mogućih terapeutskih i preventivnih strategija. I dok se može činiti da je razvoj takvih medicinskih proizvoda, uključujući cjepiva, ekstremno brz u usporedbi sa standardnim razvojem, istina je da je ovo bio uistinu globalan napor na više razina. Kako bi bili tako nevjerojatno brzi, bilo je potrebno posegnuti za uporabom/testiranjem novih i starih tehnologija, za novim dotad nezabilježenim suradnjama, za političkom i ekonomskom voljom i za fokusom vezanim za regulatorna odobrenja. Kada spominjemo pretklinička i klinička isttaživanja, cilj je bio što više aktivnosti provesti paralelno, a istovremeno zadržati željenu razinu kvalitete i sigurnosti.
Obično, da bi se razvilo novo cjepivo potrebno je desetljeće, iako se u skorija vremena, mimo COVID-19, vremena skraćuju sve više. Ipak, vrijeme isporuke gotovih cjepiva je bilo ekstremno i iziskivalo je manje od 12 mjeseci do finalnog produkta. Stoga je razumljivo što se brojni pitaju jesu li se poduzimale ikakve prečice u procesu.
Kada se spominje kliničko istraživanje, kompromis za sigurnost i kvalitetu ne smije postojati, ali se pojedine faze i dijelovi mogu provesti paralelno kako bi se uštedilo na vremenu. Srećom, istraživanja su rezultirala pozitivnim rezultatima i regulatorna tijela su se obvezala da će provjeriti rezultate u dotad neviđenom rekordnom vremenu. Potrebno je shvatiti da je za standarni razvoj svaki korak iziskivao dosta veremena, ponekad godine. Time se ne želi smanjiti vrijednost i teret ostalih bolesti ili istaknuti da je razvoj cjepiva protiv COVID-19 bio olakšan. Najveća razlika je da je uistinu globalna prijetnja bila prisutna i da bez želje, volje i predanosti uljučenih strana, još uvijek ne bi imali nijedno cjepivo. Ono što je također pomoglo je entuzijazam javnosti koje je rezultiralo u rekordnoj regrutaciji sudionika u kliničkim studijama. Uz to, virus se jako brzo širio, pa je bilo relativno lako i brzo uspostaviti učinkovitost testiranih cjepiva.
Glavne komponente brzog razvoja cjepiva tijekom COVID-19 pandemije su bile:
- Proizvodnja pod rizikom
- Pojednostavljen proces regulatornog odobrenja
- Određivanje prioriteta
- Globalna nastojanja
- Sredstva i doprinosi
Tipovi cjepiva protiv COVID-19
Trenutno, u raznim zemljopisnim prostorima, različita cjepiva se nude, ovisno o regulatornim odobrenjima u zemlji. U SAD-u, 3 cjepiva su potpuno odobrena ili imaju odobrenje za hitnu uporabu (engl. emergency use authorization (EUA)): Comirnaty/BNT162b2 (proizvođač BioNTech/Pfizer), Spikevax/mRNA-1273 (proizvođač Moderna) i Janssen COVID-19/Ad26.COV2.S (proizvođač Janssen farmaceutska tvrtka Johnson & Johnson) cjepiva. U Europi, uz 3 navedena cjepiva, Nuvaxovid/Covovax/NVX-CoV2373 (proizvođač Novavax) i Vaxzevira/Covishield/AZD1222 (proizvođač Oxford/AstraZeneca) su odobrena za uporabu. Drugdje, Sputnik V/Gam-Covid-Vac (proizvođač Gamaleya), Convidecia/Ad5-CoV (proizvođač CanSino Bio), BBIBP-CorV (proizvođač Sinopharm), CoronaVac (proizvođač SinoVac) BBV152/Covaxin (proizvođač Bharat Biotech) se također koriste.
Detalji 5 najčešće korištenih cjepiva u SAD-u i EU se mogu pronaći u nastavku (boja odgovara korištenoj tehnologiji).





No, kamo nas sve to vodi? Cjepiva protiv COVID-19 nisu zaustavila pandemiju u potpunosti, ali su pomogla držati ju pod kontrolom do neke razine i usporiti širenje, zajedno s držanjem distance i korištenjem maski. Glavni ciljevi cijepljenja, zajedno s drugim mjerama, su bili prevencija širenja bolesti i smanjenje razvoja težih oblika bolesti te hospitalizacija. Tijekom pandemije, znanost je pokazala da može držati korak s izazovom.
Unatoč tomu, postoje i drugi važni faktori koji će utjecati na uspjeh budućih lijekova i cjepiva. Proces razvoja COVID-19 cjepiva se u potpunosti odvio pred očima javnosti i medija. Kako je razvoj medicinskih proizvoda jako složen proces, s greškama i čestim promjenama, za širu javnost koja normalno vidi samo krajnji rezultat, može se činiti neurednim i čak neznanstvenim.
Većina znanstvenika je zapravo sretna što transparentnost i vidljivost postaju sve važniji i što se šira javnost sve više uključuje. Unatoč tomu, daljnje obrazovanje o poznavanju procesu je potrebno, kako bi se spriječilo nepotrebno ispitivanje. I dok su izazovi, pitanja i interes javnosti potpuno opravdani, mora postojati ravnoteža između razumne i nerazumne kritike. I da, postoji mnogo toga što je još uvijek nepoznato, ali to je sasvim u redu. Morat ćemo svi zajedno raditi na tome da najbolji i najpotrebniji lijekovi budu dostupni na tržištu. Svi smo odgovorni pobrinuti se da javnost razumije razvoj proizvoda i želi koristiti iste.
Budućnost razvoja cjepiva je svakako svijetla, ali ne ovisi samo o znanstvenim postignućima i tehnologiji. Razgovor, prihvaćanje i razumijevanje su potrebni kako bi se premostili postojeći nedostatci u poznavanju znanosti i transparentnosti u razvoju, pogotovo kada se radi o široj javnosti. Naposlijetku, unatoč svim postignućima na razini bržeg i jednostavnijeg razvoja, bit ćemo toliko uspješni koliko nam javnost “dopusti”.
“Sami možemo postići tako malo; zajedno možemo učiniti tako mnogo.”
Helen Keller
Bibliografija
Acosta P. et al. Brief History and Characterization of Enhanced Respiratory Syncytial Virus Disease, Clin Vaccine Immunol. 2016 Mar; 23(3): 189–195.
Alameda County Public Health Department. 2022. “Communicable Disease.” Last edited in 2022. https://acphd.org/communicable-disease/
Beans C. Researchers getting closer to a “universal” flu vaccine, PNAS. 2022 Jan; 119 (5) e2123477119.
Centers for Disease Control and Prevention (CDC). 2022. “Administer the Vaccine(s).” Last edited on 8 September 2021. https://www.cdc.gov/vaccines/hcp/admin/administer-vaccines.html
Centers for Disease Control and Prevention (CDC). 2022. “How Flu Viruses Can Change: “Drift” and “Shift”.” Last edited on 21 September 2021. https://www.cdc.gov/flu/about/viruses/change.htm
Cell Signaling Technology (by April Lowell). 2022. “Immunology: How does the innate immune system work?” Last edited on 29 July 2020. https://blog.cellsignal.com/immunology-how-does-the-adaptive-immune-system-work
Encyclopedia.com. 2022. “Hemagglutinin (HA) And Neuraminidase(NA).” Last edited on 28 March 2022. https://www.encyclopedia.com/science/encyclopedias-almanacs-transcripts-and-maps/hemagglutinin-ha-and-neuraminidasena
European Medicines Agency. 2022. “COVID-19 vaccines: development, evaluation, approval and monitoring.” https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-development-evaluation-approval-monitoring
Gavi The vaccine alliance. 2022. “How did scientists manage to develop safe COVID-19 vaccines in just ten months?” Last edited on 17 December 2020. https://www.gavi.org/vaccineswork/how-did-scientists-manage-develop-safe-covid-19-vaccines-just-ten-months
Goetz K. et al. First-in-human clinical trials with vaccines—what regulators want, Nature Biotechnology. 2010 Sep; 28: 910–916.
La Pipette. 2022. “COVID-19 vaccine cards.” Last edited on 9 May 2021. https://lapipette.com/vaccine_cards
Northeastern University (by Roberto Molar Candanosa). 2022. “Here’s what it takes to test a COVID-19 vaccine with clinical trials.” Last edited on 2 October 2020. https://news.northeastern.edu/2020/10/02/heres-what-it-takes-to-test-a-covid-19-vaccine-with-clinical-trials/
Royal Society of Chemistry (by Katrina Megget). 2022. “Covid-19 is forcing pharma to rethink clinical trials.” Last edited on 25 June 2020. https://www.chemistryworld.com/news/covid-19-is-forcing-pharma-to-rethink-clinical-trials/4012063.article
The Conversation (by Jo Adetunji). 2022. “H1N1, H5N1, H7N9? What on earth does it all mean.” Last edited on 4 June 2013. https://theconversation.com/h1n1-h5n1-h7n9-what-on-earth-does-it-all-mean-14815
U.S. Department of Health & Human Services. 2022. “Vaccine Types.” Last edited on 29 April 2021. https://www.hhs.gov/immunization/basics/types/index.html
Wikipedia. 2022. “COVID-19 pandemic.” Last edited on 5 April 2022. https://en.wikipedia.org/wiki/COVID-19_pandemic
Wikipedia. 2022 “Pandemic.” Last edited on 5 April 2022. https://en.wikipedia.org/wiki/Pandemic
Wikipedia. 2022 “Serious adverse event.” Last edited on 6 October 2021. https://en.wikipedia.org/wiki/Serious_adverse_event
World Health Organization. 2022. “How are vaccines developed?” Last edited on 8 December 2020. https://www.who.int/news-room/feature-stories/detail/how-are-vaccines-developed
World Health Organization. 2022. “How do vaccines work?.” Last edited on 8 December 2020. https://www.who.int/news-room/feature-stories/detail/how-do-vaccines-work
World Health Organization. 2022. “The different types of COVID-19 vaccines?.” Last edited on 12 January 2021. https://www.who.int/news-room/feature-stories/detail/the-race-for-a-covid-19-vaccine-explained
Yale Medicine (by Kathy Katella). 2022. “Comparing the COVID-19 Vaccines: How Are They Different?” Last edited on 30 March 2022.
https://www.yalemedicine.org/news/covid-19-vaccine-comparison